圣堃環保科技(上海)有限公司作者
活性污泥生物硝化技術介紹,快來看看吧!
目前,生物脫氮技術已被廣泛應用在污水處理系統中.其中的硝化作用包括氨氧化細菌(AOB)將氨氮(NH+4-N)轉化為亞硝酸鹽氮(NO-2-N)及亞硝酸鹽氧化細菌(NOB)再將NO-2-N轉化成硝酸鹽氮(NO-3-N)的過程.由于硝化細菌較低的增長速率及對pH、溶解氧濃度、溫度、有毒化學品等具有*的敏感性,因此,硝化作用一直被視為脫氮過程中的限速步驟.
重金屬銅(Cu)是一種重要工業原材料,被廣泛用于制革、電鍍、金屬加工等行業,其中,金屬加工、電鍍工廠所排放的廢水中Cu2+含量zui高,濃度可達幾十至幾百mg · L-1.同時,含銅工業廢水還經常會進入市政污水系統,從而影響污水廠的生物硝化處理效果.研究發現,純培養的硝化細菌對Cu2+比較敏感,Cu2+的半抑制濃度(IC50)為13.3 mg · L-1.活性污泥體系中,硝化菌群對Cu2+的耐受性有所提高,50 mg · L-1的Cu2+可以抑制50%的NH+4-N降解速率.與其他重金屬(如Zn、Cd、Ni)相比,硝化性能受Cu抑制后需要更長的恢復時間.由于不同試驗中pH、污泥類型、污泥濃度及有機物質等因素的差別,因此,不同研究得到的Cu2+對活性污泥的抑制效果往往有差異,但幾乎所有的報道都認同高濃度的Cu2+對硝化反應的抑制作用.目前,已有的研究多從動力學角度考察Cu2+沖擊負荷對硝化效果的抑制,然而短期的沖擊實驗不足以反映受持續毒性的抑制情況,而針對Cu2+持續負荷及負荷結束后硝化性能變化的研究還相對較少.
因此,本文主要采用間歇式活性污泥反應器(SBR),研究Cu2+持續負荷期間及結束后AOB和NOB硝化菌群活性的變化,通過檢測硝化效率、微生物活性、Cu分布特點等信息,探討Cu2+對生物硝化過程抑制的作用原理.
2 材料與方法
2.1 模擬生活污水和接種污泥
試驗采用人工模擬生活污水,模擬污水COD為500 mg · L-1,NH+4-N 75 mg · L-1,pH=7.5±0.5,具體組分為(mg · L-1):*480,NH4Cl 75,KH2PO4 30,NaHCO3 350,MgSO4 · 7H2O 20,FeSO4 · 7H2O 2.5,ZnSO4 · 7H2O 0.25,CaCl2 · 2H2O 10,CoCl2 · 6H2O 0.00005,MoO3 0.0015.根據試驗需要向模擬生活污水中投加適量硫酸銅儲備液(Cu2+濃度25 g · L-1),配置不同濃度的含Cu生活污水.在pH為7.5左右的含銅進水中,Cu2+可以和OH-(水解產物)、CO2-3(來自于350 mg · L-1 NaHCO3的HCO-3和CO2-3)、氨(來自于75 mg · L-1 NH4Cl的NH3)等形成溶解態Cu(OH)-n+2n、Cu(CO3)-2n+2n、 Cu(NH3)2+n等絡合物(后文統稱為Cu2+),以及 Cu(OH)2和CuCO3等難溶物質.
接種污泥取自天津某污水處理廠A2O曝氣池,并用模擬生活污水在SBR中馴養至出水NH+4-N穩定小于0.5 mg · L-1后開始試驗.
2.2 試驗裝置
反應器有效容積5 L,內徑為100 mm,總高850 mm(圖 1).SBR運行參數:自控裝置控制運行周期,處理水量為2.5 L · 周期-1,每周期6 h,包括進水5 min,曝氣240 min,靜沉75 min,排水10 min,靜置30 min;溫度(25.0±0.5)℃.進水水箱中設有循環泵,確保進水成份均勻.曝氣時控制反應器內DO≥2 mg · L-1.實驗過程中平均1天排1次泥,保證MLSS為5000 mg · L-1左右,污泥齡約為6 d.
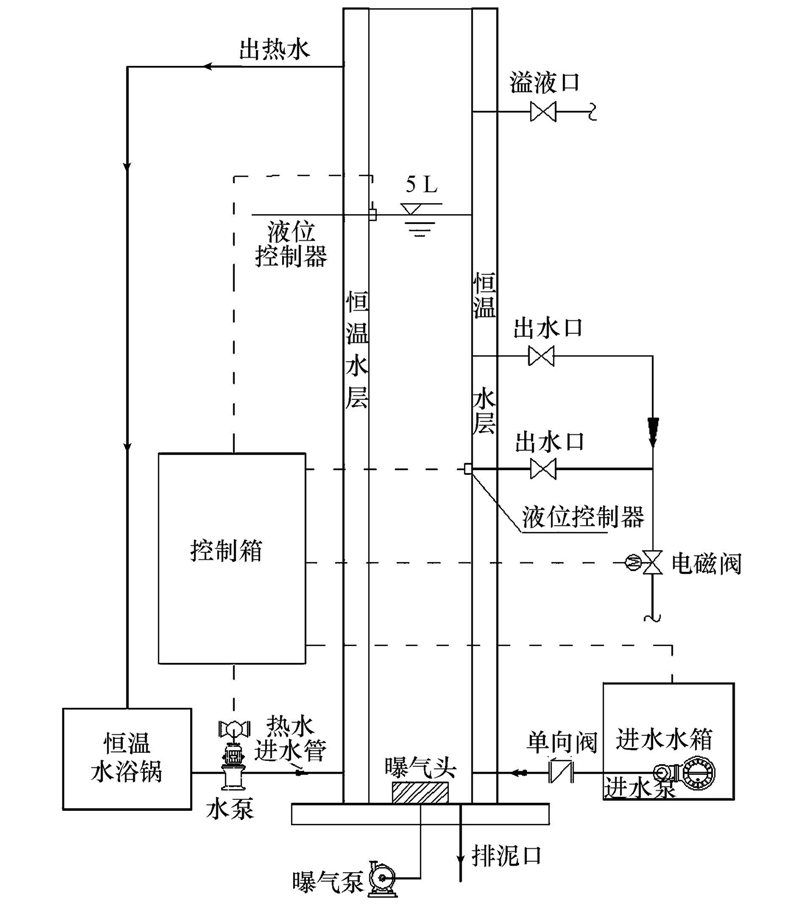
圖 1 SBR反應器裝置圖
2.3 試驗方法
試驗采用5個相同的SBR反應器進行持續負荷試驗.其中1個反應器為對照體系,進水始終為不含Cu2+的模擬污水.另外4個反應器在第1~20周期內的進水為不含Cu2+的模擬污水,該階段為初始階段;第21周期后,4個反應器的進水變為含Cu2+濃度分別為10、20、30和50 mg · L-1的模擬污水,該階段為抑制階段;當各反應器的出水NH+4-N保持穩定后,停止向進水中加Cu2+,系統進入恢復階段.
2.4 生物活性的表征
AOB、NOB及異養菌的活性主要用氨氧化比耗氧速率(SOURNH4)、亞硝酸鹽氮氧化比耗氧速率(SOURNO2)和碳氧化比耗氧速率(SOURorg.C)來表征.活性污泥各項SOUR的測定參見文獻.微生物活性的抑制率I用下式計算:
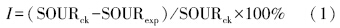
式中,SOURck為對照組SOUR(mg · g-1 · min-1,以MLSS計),SOURexp為各實驗組SOUR(mg · g-1 · min-1,以MLSS計).
恢復期,投加Cu2+的4個反應器出水中NH+4-N和NO-3-N濃度變化率分別用kNH4和kNO3表示,其中,kNH4、kNO3可以用來評價AOB和NOB菌群的恢復速率.
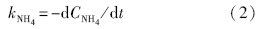

式中,CNH4是出水中NH+4-N濃度(mg · L-1),CNO3是出水中NO-3-N濃度(mg · L-1),t是周期數,kNH4為恢復期NH+4-N的消耗速率(mg · L-1· 周期-1),kNO3為恢復期NO-3-N的生成速率(mg · L-1· 周期-1).
2.5 反應體系中Cu的分布
反應器體系內的總銅、溶解態銅、活性污泥內部的銅、活性污泥表面吸附的銅可以反映銅在體系內的分布,結合硝化作用的抑制可分析出銅對硝化細菌的影響.測定活性污泥內部的銅主要運用洗脫液(1 mmol · L-1 EDTA,pH=7.0,0.1 mol · L-1 NaCl)洗脫泥樣后測定的方法.洗脫液使活性污泥表面吸附的銅解吸附,洗脫后殘留在泥樣內的銅被認為是進入細胞內部的銅.將用洗脫液洗脫后的泥樣、過濾后的水樣、泥水混合樣加酸進行微波消解后,用火焰原子吸收儀測定銅的濃度,分別得到活性污泥內部的銅、溶解態銅、總銅含量.總銅減去溶解態銅和活性污泥內部的銅后可得到活性污泥表面吸附的銅.
2.6 常規測試項目
COD:COD消解儀+分光光度法;NH+4-N:納氏試劑分光光度法;硝酸鹽氮:酚二磺酸光度法;亞硝酸鹽氮:N-(1-萘基)-乙二胺光度法;MLSS:重量法;DO和pH:在線測定儀.
3 結果與討論
3.1 Cu2+的持續負荷對系統處理性能的影響
各反應器在初始階段硝化效果良好,出水NH+4-N均低于0.5 mg · L-1,NH+4-N去除率均大于99%(圖 2a).第20周期,進水變為含Cu2+污水后,Cu2+對NH+4-N去除的抑制作用隨著Cu2+濃度和運行周期變化顯著.在10、20、30和50 mg · L-1 Cu2+的抑制下,NH+4-N去除率分別在第84、72、28和24周期開始迅速下降,在第100、96、58和42周期分別降至31.3%、29.3%、27.1%和22.5%.各反應器初始階段,出水NO-2-N濃度低于1 mg · L-1(圖 2b);進水改為含Cu2+污水后,各反應器都首先出現了NO-2-N積累現象,隨后NO-2-N以不同速率降低.出水NO-3-N在10和20 mg · L-1 Cu2+體系中的降低出現較晚且緩慢(圖 2c),而30和50 mg · L-1 Cu2+體系中NO-3-N在抑制周期內很快由(37.0±2.0)mg · L-1降至(1.0±0.5)mg · L-1.在10、20 mg · L-1 Cu2+體系的抑制初期,出水NH+4-N濃度保持穩定,而出水NO-2-N濃度先增加后降低,表明體系中NOB受到抑制后逐漸被*或者部分馴化,從而逐漸適應含Cu2+的環境.在30、50 mg · L-1 Cu2+體系中,出水NH+4-N濃度提高,表明高濃度的Cu2+對AOB和NOB都產生了嚴重抑制.
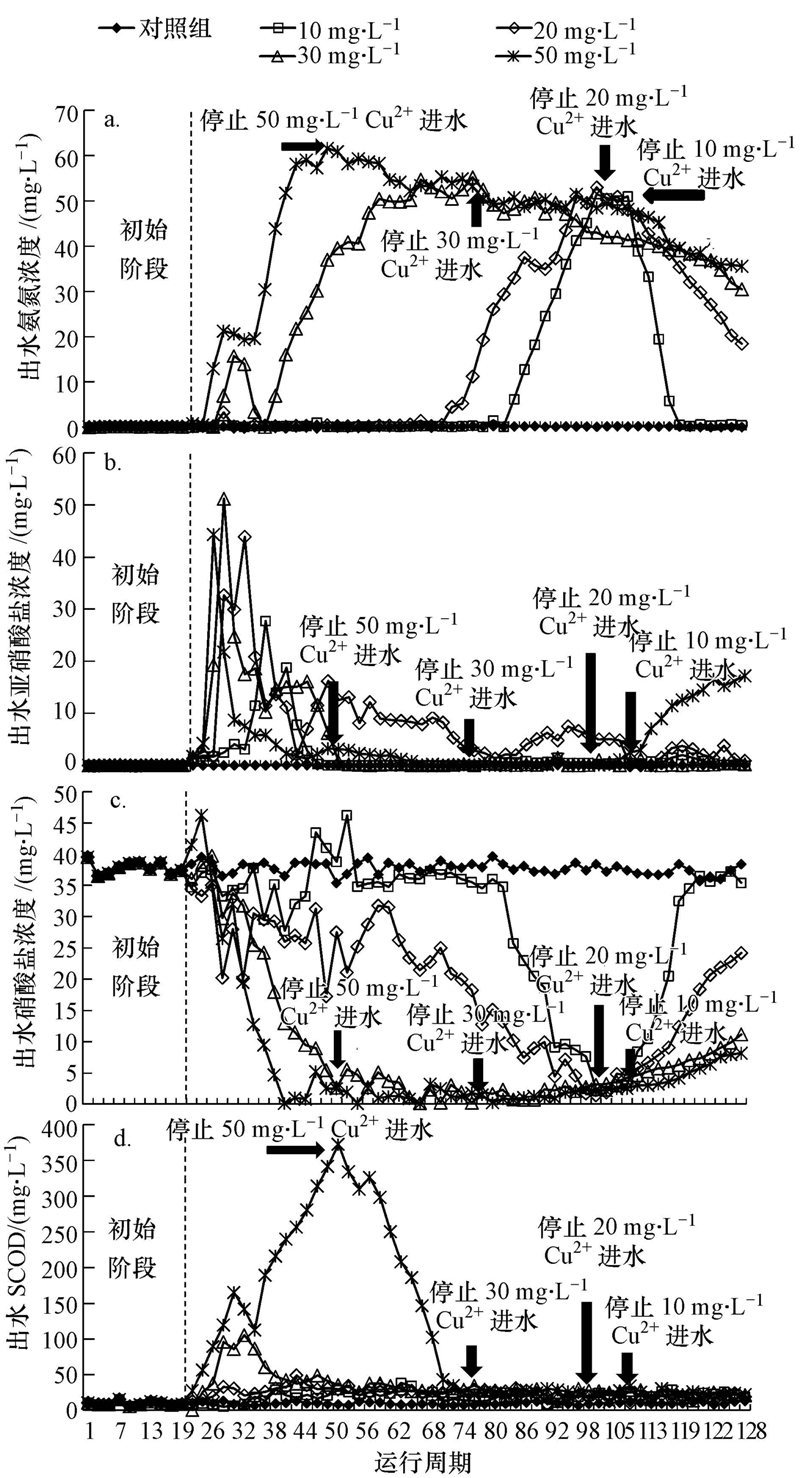
圖 2 SBR系統受含Cu2+廢水抑制及系統恢復階段的運行效果
SCOD的去除同樣受到Cu2+影響,當進水Cu2+為10、20 mg · L-1時Cu2+對SCOD的去除影響較小,出水SCOD從(10±5)mg · L-1上升至(20±5)mg · L-1(圖 2d),表明異養菌活性受低濃度Cu2+的毒性影響較小;而當廢水中Cu2+濃度為30 mg · L-1時,出水SCOD經12個周期后增至(100±5)mg · L-1,但隨后微生物逐漸適應Cu2+負荷,經過10個周期運行后,出水SCOD降至(30±5)mg · L-1,表明該濃度下異養菌能逐漸被馴化;50 mg · L-1 Cu2+體系中,出水SCOD隨運行時間呈上升趨勢,zui高達到370 mg · L-1.根據理論計算,異養菌降解500 mg · L-1的COD(480 mg · L-1葡萄糖,C6H12O6)需消耗31 mg · L-1左右的NH+4-N,這與10、20和30 mg · L-1 Cu2+體系抑制穩定時NH+4-N的去除量((28±3)mg · L-1)較接近.因此,在抑制試驗運行末期,10、20和30 mg · L-1 Cu2+體系中NH+4-N的去除主要是異養菌代謝的結果,硝化作用被*抑制.但在50 mg · L-1 Cu2+體系中,在抑制試驗運行末期,NH+4-N去除量僅為15 mg · L-1左右,小于異養菌正常代謝消耗的NH+4-N,說明高濃度Cu2+對異養菌也產生了抑制,這與50 mg · L-1 Cu2+體系中SCOD的去除率降低相一致.
3.2 Cu2+的持續負荷后生物硝化效率的恢復
10、20、30和50 mg · L-1 Cu2+的進水反應體系分別在第107、100、75和51周期抑制達到穩定,進水中然后停止投加Cu2+,進入恢復階段.硝化效率在10 mg · L-1 Cu2+體系中恢復較快,恢復13個周期(第120周期)后,NH+4-N去除率恢復到初始階段的水平(圖 2a);20、30、50 mg · L-1 Cu2+體系在分別恢復了19、44、69個周期后,NH+4-N去除率達到初始階段的48.8%、34.8%、46.2%.恢復期內,10、20、30 mg · L-1 Cu2+體系中NO-2-N無明顯積累,體系中生成的NO-2-N能被氧化成NO-3-N.50 mg · L-1 Cu2+體系中,恢復初期NH+4-N去除率的提高并沒有伴隨NO-2-N或者NO-3-N明顯生成,說明此時NH+4-N的消耗可能不是硝化菌的作用.此時50 mg · L-1 Cu2+體系中SCOD的去除效率恢復到初始階段的水平,根據3.1節中關于異養菌消耗NH+4-N的討論,此時50 mg · L-1 Cu2+體系中NH+4-N的消耗主要是恢復活性的異養菌代謝的結果.恢復末期,50 mg · L-1 Cu2+體系中出水NH+4-N繼續降低,NO-3-N生成,并出現NO-2-N積累現象,這主要是因為隨著運行周期的延長,AOB、NOB均有一定程度的恢復,而且AOB恢復速度比NOB快.根據公式(2)、(3),恢復期各反應體系的出水中NH+4-N消耗速率和NO-3-N的生成速率分別為kNH4=0.24~5.20 mg · L-1 · 周期-1,kNO3=0.04~2.59 mg · L-1 · 周期-1.kNH4和kNO3均隨投加Cu2+濃度的增加而降低,表明在抑制期投加Cu2+的濃度越高的體系中AOB和NOB恢復速率越慢(圖 3).當Cu2+投加濃度相同時,kNH4大于kNO3,但此時并沒有NO-2-N積累,這可能是由于異養菌活性也在恢復,其消耗的NH+4-N量也在增加.
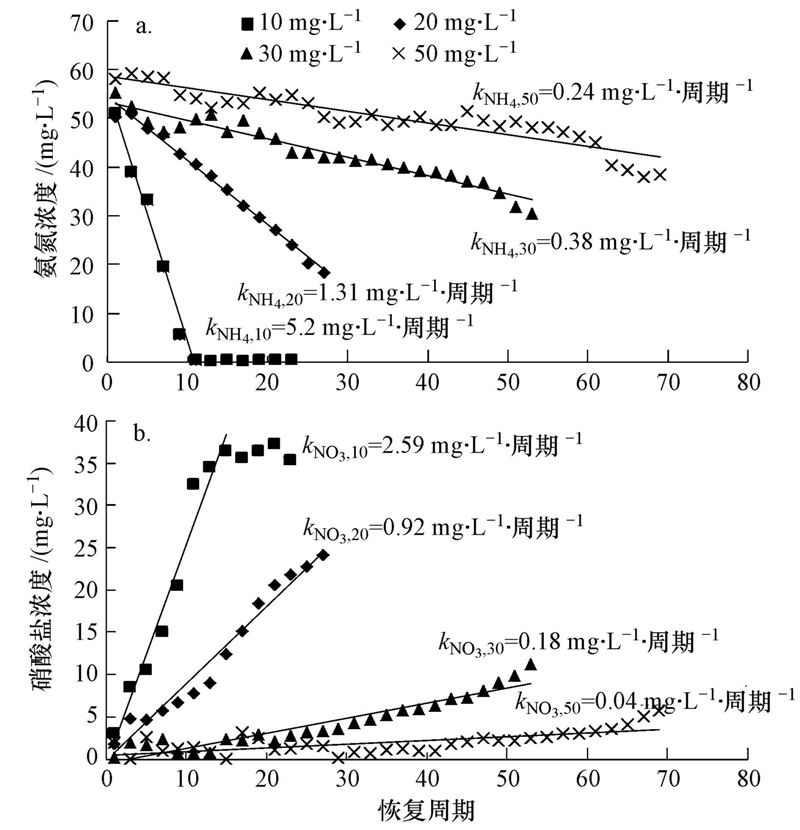
圖 3 SBRs反應器恢復期的氨氮消耗速率(a)和硝酸鹽氮生成速率(b)
3.3 Cu2+持續負荷對生物硝化菌群活性的抑制及活性恢復效果
氨氧化SOURNH4和亞硝酸鹽氮氧化SOURNO2分別表征了AOB和NOB的活性變化.如圖 4a所示,未投加Cu2+時,SOURNH4和SOURNO2分別為0.147和0.098 mg · g-1 · min-1(以MLSS計).抑制試驗穩定期時,10、20、30和50 mg · L-1 Cu2+體系的SOURNH4抑制率分別達到89.1%、91.8%、95.2%和95.9%,SOURNO2的抑制率分別達到16.4%、46.3%、72.5%和94.9%.說明Cu2+對硝化細菌的抑制作用明顯,并且對AOB的抑制作用大于NOB,即使低濃度的Cu2+也能使AOB基本失活.恢復試驗末期,10、20、30和50 mg · L-1 Cu2+體系中SOURNH4分別恢復了60.4%、12.6%、5.8%和3.9%,SOURNO2分別恢復了9.0%、8.1%、4.8%和3.2%,說明AOB和NOB隨恢復時間的增加能逐漸恢復部分活性,Cu2+濃度越低,恢復越快.
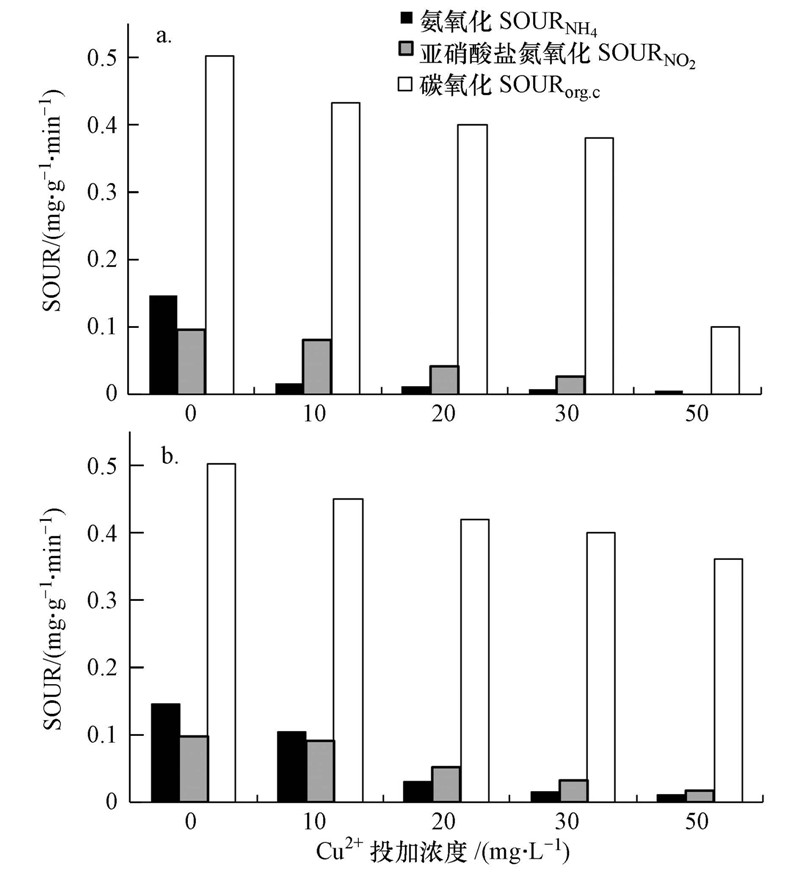
圖 4 Cu2+投加濃度對SOUR的影響(a.抑制穩定期SOUR;b.恢復末期SOUR)
表征異養微生物活性的SOURorg.C受10、20、30 mg · L-1的Cu2+持續負荷影響較小,而受50 mg · L-1的Cu2+負荷影響較大.對照組的SOURorg.C為0.503 mg · g-1 · min-1(以MLSS計).抑制穩定期時,10、20、30和50 mg · L-1體系中SOURorg.C抑制率分別為13.8%、21.5%、24.5%和80.0%,這和SCOD的降解抑制率較為相符;恢復試驗末期,各反應器SOURorg.C恢復至初始階段的80%±10%.由此可見,當Cu2+濃度≤30 mg · L-1時,Cu2+對異養菌的活性抑制程度較小且易恢復;當Cu2+濃度為50 mg · L-1時,Cu2+對異養菌的活性抑制程度較大,僅能部分恢復.
3.4 反應體系內Cu的分布和積累
在反應體系內銅的分布主要有3種形式:溶解態銅、活性污泥內部的銅和活性污泥吸附的銅;三者之和為體系內總銅.銅在SBR內顯著積累,表明活性污泥對銅的吸附能力很強.在10、20、30和50 mg · L-1 Cu2+體系中活性污泥內部的銅分別占總銅的35.9%、36.7%、36.1%和35.4%,活性污泥吸附的銅分別占總銅的62.4%、59.6%、60.0%和56.8%(圖 5).由此可見,在不同濃度體系中銅在三相中的分布比例基本相近,其中,活性污泥吸附的銅大于進入活性污泥內部的銅.將NH+4-N去除率與活性污泥吸附和內部的銅分別進行相關分析,未發現明顯的相關關系(圖 6a和b,p>0.05).在持續的銅負荷下,當活性污泥內部和其表面吸附的銅分別積累到(5.0±0.5)和(9.0±0.5)mg · g-1(以MLSS計)時,各濃度體系的NH+4-N降解去除率急劇下降.Hu等(2003)的研究表明,銅對硝化細菌抑制與細胞吸附和細胞內部的銅濃度無明顯線性關系,此結果和本文相一致.各濃度體系中NH+4-N去除率與溶解態銅濃度呈負相關性(p<0.05),NH+4-N去除率隨體系內溶解態銅濃度的增加不斷降低(圖 6c).Ochoa-Herrera等(2011)研究銅對硝化細菌的沖擊試驗時表明,相比總銅濃度而言,溶解態銅能更好地反映硝化的抑制情況.
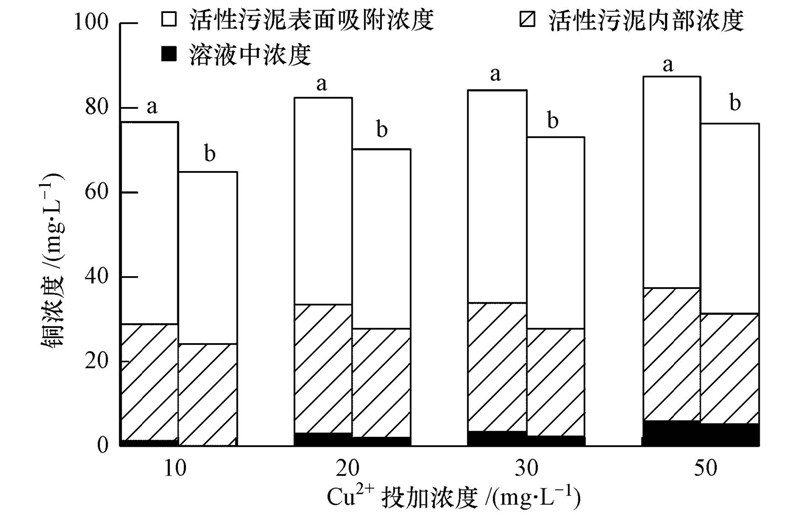
圖 5 四個SBRs中銅的分布情況(a.抑制穩定期;b.恢復25周期后)

圖 6 不同形態的銅和氨氮去除率的相關性(a.活性污泥內部的銅;b.活性污泥吸附的銅;c.溶解態的銅)
各體系分別恢復25個周期后,反應體系內的總銅減少并不明顯,相較于各自抑制穩定期,10、20、30和50 mg · L-1 Cu2+體系中活性污泥內的銅分別減少14.4%、15.1%、16.4%和16.2%,活性污泥吸附的銅分別減少14.8%、13.0%、10.1%和10.3%,溶解態銅分別減少了47.6%、37.8%、27.9%和26.6%(此時溶解態的銅濃度分別為0.58、1.83、2.32、5.02 mg · L-1).結果表明,活性污泥內部及其表面吸附的銅不易解析出來,且殘余濃度降低比例相近,但溶解態銅在不同濃度體系中降低的量差異較大,降低的比例越大,NH+4-N去除率恢復速率越快,且恢復程度越大.所以,恢復過程同樣體現了硝化的抑制率與溶解態銅濃度的相關性較好.
當含銅廢水zui初進入反應體系后,大量的銅被活性污泥固定,體系內溶解態銅濃度很快降低.這可能由于活性污泥的吸附作用促進了反應器中Cu(OH)2、CuCO3的生成和沉淀,從而產生的銅聚合物沉積在菌體表面,被活性污泥捕獲.隨著Cu的不斷投加,無法被固定的銅參與到氧化還原體系中生成羥基自由基,從而破壞了細胞膜功能.低濃度Cu2+體系中(10、20 mg · L-1),銅投加濃度小,較晚達到吸附飽和,且溶解態銅濃度也較低,參與氧化還原的銅相對較少,對AOB細胞膜未產生不可逆的影響,所以恢復期硝化能力較易恢復.高濃度Cu2+體系中(50 mg · L-1),銅投加量較大,很快達到飽和量,溶解態銅濃度較高從而嚴重破壞了AOB細胞膜,導致氨氧化性能急劇下降,恢復過程也較為緩慢.與AOB抑制情況不同,從抑制穩定期的亞硝酸鹽氧化性能和NOB的耗氧速率的變化可看出,NOB菌群能逐漸被馴化從而適應低濃度銅的環境.也提出在重金屬的影響下,AOB比NOB更易受到抑制.
4 結論
1)SBR活性污泥系統中硝化效率較易受到Cu2+的持續負荷影響,對NH+4-N去除的抑制作用隨著Cu2+濃度的增大和運行周期的延長變得顯著.在抑制期,進水中持續的10、20、30和50 mg · L-1的Cu2+負荷使NH+4-N去除率分別在抑制87、80、55、31個周期之后降低至31.3%、29.3%、27.1%、22.5%.在恢復階段,AOB和NOB的恢復速率隨著抑制期投加Cu2+濃度的增加而降低.10~20 mg · L-1 Cu2+體系中,NOB可以被全部或者部分馴化,10~30 mg · L-1 Cu2+的體系內,異養菌可以全部被馴化.
2)Cu2+對硝化細菌的活性抑制作用明顯.在抑制期,Cu2+濃度為10~50 mg · L-1時,AOB活性抑制率為89.1%~95.5%,NOB抑制率為16.4%~94.9%,異養菌抑制率為13.8%~80.0%.各體系中Cu2+對菌群的抑制率為:AOB>NOB>異養菌.
3)抑制期,各系統內銅主要分布在細胞內部和表面,且恢復過程中不易解析.當活性污泥內部和其表面吸附的銅分別積累到(5.0±0.5)和(9.0±0.5)mg · g-1(以MLSS計)時,各濃度體系的NH+4-N降解去除率急劇下降.硝化抑制率與溶解態的銅濃度呈負相關.
上一篇:地熱能多元化發展
下一篇:純水處理各專業名詞詳細解析
- 版權與免責聲明
- 1、凡本網注明"來源:環保在線"的所有作品,版權均屬于環保在線,轉載請必須注明環保在線,http://www.kindlingtouch.com。違反者本網將追究相關法律責任。
- 2、企業發布的公司新聞、技術文章、資料下載等內容,如涉及侵權、違規遭投訴的,一律由發布企業自行承擔責任,本網有權刪除內容并追溯責任。
- 3、本網轉載并注明自其它來源的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點或證實其內容的真實性,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品來源,并自負版權等法律責任。
- 4、如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
-
型號:ZBXN
-
型號:
-
型號:
-
型號:
-
型號:
-
型號:
 環保在線APP
環保在線APP
 環保在線手機站
環保在線手機站
 環保在線小程序
環保在線小程序
 微信公眾號
微信公眾號























 環保在線官微
環保在線官微 環保在線APP
環保在線APP 環保在線小程序
環保在線小程序