A液:400ul (20uM濃度:每塊分離膠加入40ul;50uM濃度:每塊分離膠加入100ul;)
B液:400ul (20uM濃度:每塊分離膠加入40ul;50uM濃度:每塊分離膠加入100ul;)
注:常規使用濃度為20uM,如過表達體系;如果目的蛋白濃度較低,則建議使用50uM或者100uM濃度。(最佳使用濃度取決于蛋白,請根據每個蛋白的具體情況摸索合適的條件)
產品使用流程收起
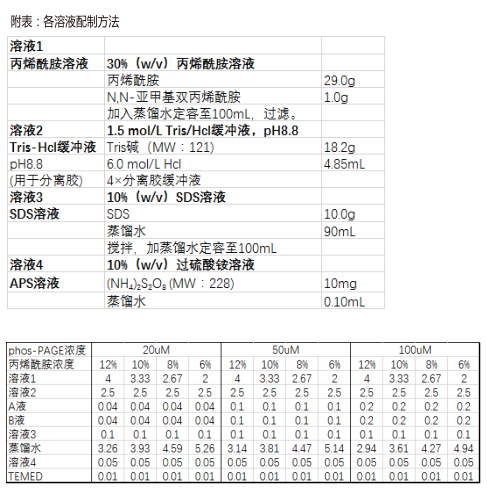
1. 按照常規配制分離膠的配方進行配膠(配方參見附表);
2. 在加入TEMED之前加入產品A液和B液(需要充分混勻);
產品保存期收起
4度避光保存,12-18個月
使用注意事項收起
1. 提高轉膜效率
電泳后,電轉之前,需要使用螯合劑(EDTA)從凝膠中除去錳離子(Mn2+)。此步驟可提高磷酸化和非磷酸化蛋白轉移到PVDF膜上的轉移效率。
1)電泳后,將凝膠在含有1?10mmol/L EDTA的轉膜緩沖液中浸泡至少10分鐘,同時輕輕搖動。(10分鐘×1?3次)。
2)接下來,將凝膠在不含EDTA的轉膜緩沖液中浸泡10分鐘,同時輕輕搖動(10分鐘×1次)。
3)強烈推薦使用濕法進行轉膜,也可以使用半干法。
2. 條帶彎曲
P-Tag電泳SDS-PAGE常見的問題是“條帶彎曲”。需要確保樣品中不含有EDTA。
1)預染的marker:由于泳道之間鹽濃度的差異,marker和樣品的條帶均會受影響。使用預染marker常常導致條帶彎曲,在含有該Marker的溶液和其他溶液之間至少需要留一條空白泳道。
2)酸性樣品:條帶可能彎曲。如果溶液為黃色至橙色,即使在加入上樣緩沖液后,請加入Tris緩沖液直到其為中性(紫色)。
3)EDTA(Mn2+被螯合),釩酸,無機鹽,表面活性劑等可引起條帶彎曲或拖尾。4)空白泳道:空白泳道可能會導致條帶彎曲。在空白泳道中加入等量的1x上樣緩沖液。
5)釩酸:競爭結合磷酸可能導致條帶彎曲。使用不同的磷酸酶抑制劑,或通過TCA沉淀或透析
6)將MnCl2添加到樣品中(如終濃度1mM)可能改善結果。如果樣品有EDTA殘留,添加的Mn2+被螯合而不是凝膠中含有的Mn2+。


 5
5




